เทคโนโลยีเพิ่มเติมอื่น ๆ ที่คุณอาจต้องการพิจารณา
เทคโนโลยีช่วยการเจริญพันธุ์ที่คุณอาจต้องการพิจารณาร่วมกับการทำเด็กหลอดแก้ว (IVF)
เทคโนโลยีช่วยการเจริญพันธุ์ที่คุณอาจต้องการพิจารณาร่วมกับการทำเด็กหลอดแก้ว (IVF) :
การแช่แข็งของตัวอ่อน
ในรอบการรักษาด้วย IVF มักจะมีการผลิตตัวอ่อนมากกว่าสองหรือสามตัว embryos ที่มีคุณภาพดีและเหลือจากการรักษาสามารถถูกแช่แข็งและนำมาใช้ใหม่ในภายหลังเพื่อเพิ่มโอกาสในการตั้งครรภ์ การแช่แข็งและการละลายต้องทำภายใต้สภาวะพิเศษ โดยมี >90% ของตัวอ่อนที่สามารถรอดจากกระบวนการนี้ เมื่อมีการละลายตัวอ่อนจะมีการติดตามรอบเดือนของผู้หญิงโดยการตรวจเลือด เพื่อให้มั่นใจว่าตัวอ่อนจะถูกย้ายกลับในช่วงเวลาที่เหมาะสมของรอบเดือน
รอบการละลายตัวอ่อนในการทำเด็กหลอดแก้ว (IVF)
เมื่อมีการแช่แข็งตัวอ่อนหลังจากการปฏิสนธินอกร่างกาย (IVF) ตัวอ่อนเหล่านั้นสามารถถูกละลายและย้ายกลับเข้าไปในมดลูกในภายหลัง โดยปกติจะมีการตรวจเลือดหลายครั้งเพื่อตรวจสอบการตกไข่ในรอบเดือนธรรมชาติ ในบางกรณีอาจจำเป็นต้องควบคุมรอบเดือนโดยใช้ยาเพื่อเตรียมมดลูกสำหรับการฝังตัวของตัวอ่อน ตัวอ่อนจะถูกย้ายเข้าไปในมดลูกในเวลาที่เหมาะสม เช่นเดียวกับในรอบการรักษาด้วย IVF
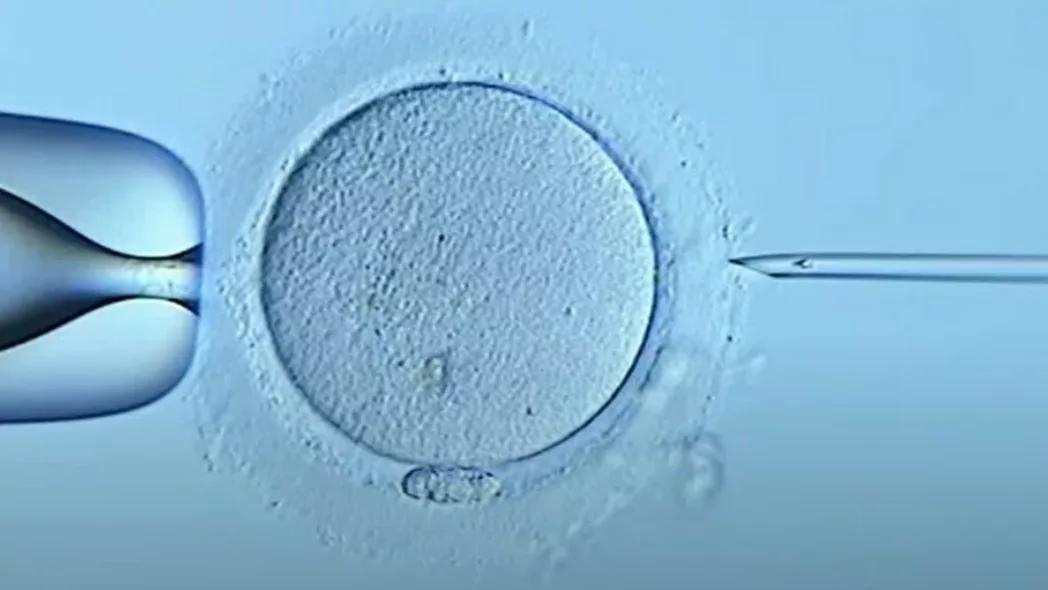
ICSI
การฉีดอสุจิเข้าไปภายในไซโตพลาสซึมหรือ ICSI เป็นขั้นตอนการฉีดอสุจิเพียงตัวเดียวเข้าไปในไข่โดยตรง เมื่อปฏิสนธิเรียบร้อยแล้ว ไข่จะเติบโตและแบ่งตัวเป็นเวลา 3- 5 วัน เพื่อสร้างเอ็มบริโอเหมือนกับการทำเด็กหลอดแก้วแบบปกติ จากนั้นเอ็มบริโอจะถูกย้ายเข้าไปในมดลูกของผู้หญิงโดยมีเป้าหมายเพื่อให้เกิดการตั้งครรภ์
ขั้นตอนการทำ ICSI
การรักษานี้คล้ายกับการทำ IVF มาก ความแตกต่างหลักคือแทนที่จะผสมอสุจิกับไข่แล้วปล่อยให้เกิดการปฏิสนธิเอง นักชีววิทยาเอ็มบริโอที่มีทักษะจะฉีดอสุจิหนึ่งตัวเข้าไปในไข่โดยตรง ซึ่งช่วยเพิ่มโอกาสในการปฏิสนธิให้สูงสุด เนื่องจากกระบวนการนี้จะข้ามผ่านปัญหาที่อาจเกิดขึ้นกับอสุจิในการเข้าไปในไข่
ขั้นตอนมี ดังนี้ :
ขั้นตอนที่ 1 : การเก็บอสุจิ
ขั้นตอนที่ 2 : การเก็บไข่
ขั้นตอนที่ 3 : การฉีดอสุจิ
ขั้นตอนที่ 4 : การสังเกต
ขั้นตอนที่ 5 : การฝังตัว
ก่อนที่จะดำเนินการ ICSI ได้ จะต้องเก็บไข่ที่โตเต็มที่ในระหว่างรอบ IVF กระตุ้นมาตรฐาน
หลังจากเก็บไข่แล้ว ชั้นเคลือบเซลล์ด้านนอก (เซลล์คิวมูลัส) จะถูกเอาออกจากไข่แต่ละฟอง เมื่อถึงเวลานั้นเราจึงมั่นใจได้ว่าไข่จะโตพอที่จะเข้ารับการทำ ICSI ได้
ไม่สามารถฉีดเข้าไข่ที่ยังไม่สุกได้ อย่างไรก็ตาม สามารถฟักตัวต่อไปอีก 2-6 ชั่วโมง และประเมินใหม่ได้ หากไข่โตเต็มที่ในขณะนั้น ยังสามารถฉีดไปพร้อมกับไข่ที่โตเต็มที่อื่น ๆ ได้ คนไข้จะได้รับแจ้งในวันรุ่งขึ้นว่าไข่โตเต็มที่กี่ฟองและฉีดไปแล้วกี่ฟอง
ตัวอย่างน้ำอสุจิได้รับการจัดเตรียมในห้องปฏิบัติการเพื่อแยกตัวอสุจิที่เคลื่อนไหวและมีสุขภาพดีสำหรับขั้นตอน ICSI ในระหว่างกระบวนการนี้ เราจะกำจัดเศษเซลล์ที่ตายแล้ว และพลาสมาน้ำเชื้อออก
การย้ายตัวอสุจิจะถูกเลือกสำหรับขั้นตอน ICSI โดยพิจารณาจากสัณฐานวิทยา (รูปร่าง) อย่างไรก็ตาม วิธีการมองเห็นนี้อาจไม่จำเป็นต้องสะท้อนถึงการทำงานหรือความสามารถในการปฏิสนธิของไข่
เครื่องมือแก้วชนิดพิเศษที่มีความละเอียดสูงมาก (เรียกว่าปิเปตแบบจับ) ใช้เพื่อจับไข่ให้อยู่นิ่ง มันเล็กมากจนแทบมองไม่เห็นปลายด้วยตาเปล่า จากนั้นจึงใช้เครื่องมือคล้ายเข็มแก้วที่บางกว่าและแหลมคมเพื่อตรึงและเก็บอสุจิเพียงตัวเดียว
ด้วยความเอาใจใส่และแม่นยำอย่างยิ่ง เข็มจึงค่อยๆ สอดผ่านเปลือกนอกของไข่ (โซนา เพลลูซิดา) และเข้าไปในตัวไข่เอง จากนั้นอสุจิที่ถูกตรึงไว้จะถูกฉีดเข้าไปในไข่อย่างช้าๆ และเข็มจะถูกดึงออกอย่างระมัดระวัง โดยปล่อยให้อสุจิอยู่ในไข่
ไข่ที่ถูกฉีดอสุจิจะถูกวางในตู้อบข้ามคืนและตรวจสอบในเช้าวันถัดไปเพื่อตรวจหาสัญญาณของการปฏิสนธิ หลังจากผ่านไปอีก 24 ชั่วโมง เราจะเริ่มสามารถระบุได้ว่าไข่จำนวนกี่ใบที่ได้แบ่งตัวและพัฒนาเป็นตัวอ่อน
สิ่งสำคัญที่ควรทราบคือ ไม่ใช่ทุกรอบที่ไข่จะปฏิสนธิ และไม่ใช่ทุกรอบไข่ที่ปฏิสนธิจะพัฒนาเป็นตัวอ่อน เช่นเดียวกับในกระบวนการ IVF ปกติ จำนวนตัวอ่อนที่ถูกย้ายเข้าไปในมดลูกขึ้นอยู่กับอายุของผู้หญิงและประวัติทางการแพทย์ หากตัวอ่อนเพิ่มเติมดูมีสุขภาพดีและเจริญเติบโตตามอัตราที่คาดหวัง ตัวอ่อนเหล่านั้นสามารถถูกแช่แข็งและเก็บรักษาไว้สำหรับการใช้ในอนาคตได้
ICSI เหมาะกับใครบ้าง?
ICSI ถูกเหมาะสำหรับคู่รักที่มีปัญหาในการปฏิสนธิที่ไม่ดีหรือไม่ได้ รวมถึงผู้ชายที่มี :
สัณฐานวิทยาของตัวอสุจิไม่ดี (ตัวอสุจิที่มีรูปร่างผิดปกติ)
การเคลื่อนไหวของอสุจิไม่ดี (เคลื่อนไหวช้า)
จำนวนอสุจิต่ำ
อุปสรรค เช่น การผ่าตัดท่อนำอสุจิ (vasectomy) ซึ่งขัดขวางการปล่อยอสุจิ
แอนติบอดีต่อต้านสเปิร์ม (แอนติบอดีที่ผลิตโดยร่างกายของมนุษย์และอาจยับยั้งการทำงานของอสุจิ)
การทำหมันชายที่ไม่ประสบผลสำเร็จหรือส่งผลให้จำนวนอสุจิต่ำหรืออสุจิมีคุณภาพต่ำ
ความเสี่ยงที่อาจเกิดขึ้นจาก ICSI มีอะไรบ้าง?
สำหรับไข่ :
เนื่องจาก ICSI เป็นกระบวนการที่มีการแทรกแซงมากกว่าและต้องใช้เวลามากกว่าการใช้เทคนิคการทำ IVF แบบปกติ จึงมีความเสี่ยงเล็กน้อย (น้อยกว่า 2%) ที่ไข่อาจจะได้รับความเสียหายระหว่างกระบวนการ ซึ่งอาจทำให้ไข่ไม่สามารถพัฒนาได้
สำหรับเด็กที่เกิด :
เด็กหลายพันคนทั่วโลกเกิดมาจากการทำ ICSI จนถึงขณะนี้ ยังไม่มีหลักฐานที่น่าเชื่อถือว่าอุบัติการณ์ของความพิการแต่กำเนิดแตกต่างกับ ICSI หรือ IVF เมื่อเทียบกับเด็กที่เกิดจากพ่อแม่ที่มีอายุและสุขภาพใกล้เคียงกัน
การตรวจคัดกรองพาหะนำโรคทางพันธุกรรม
การตรวจคัดกรองพาหะทางพันธุกรรมจะให้ข้อมูลแก่บุคคลและคู่สมรสเกี่ยวกับความเสี่ยงในการมีบุตรที่มีภาวะทางพันธุกรรม
ตอนนี้เรามีตัวเลือกในการทดสอบทางพันธุกรรมผ่าน Invitae ซึ่งสามารถทำได้ทั้งเพื่อข้อมูลของคุณเอง หรือเพื่อเช็คความเข้ากันได้กับคู่ของคุณหรือผู้บริจาคที่เป็นไปได้
การคัดกรองพันธุกรรมจะช่วยระบุว่าคุณเป็นพาหะของภาวะทางพันธุกรรมที่ถ่ายทอดได้หรือไม่ คนส่วนใหญ่เป็นพาหะของภาวะพันธุกรรมหนึ่งหรือมากกว่า แม้ว่าไม่มีใครในครอบครัวจะมีภาวะนั้น การเป็นพาหะเป็นสิ่งสำคัญ หากผู้ที่ใช้สเปิร์มเป็นพาหะของภาวะเดียวกัน
การคัดกรองพาหะนำโรคทางพันธุกรรม ได้แก่ :
โรคที่รุนแรงและพบได้บ่อยในทุกเชื้อชาติ
การทดสอบ SMA ที่พัฒนาเพื่อช่วยในการระบุพาหะแฝง
การวิเคราะห์ Fragile X ที่ครอบคลุมรวมถึงการหยุดชะงักของ AGG
การตรวจหาลำดับยีนทั้งหมดพร้อมการวิเคราะห์การลบและการเพิ่มจำนวน ทำให้สามารถตรวจพบได้ถึง 99% สำหรับยีนส่วนใหญ่
ผลลัพธ์ที่สามารถนำไปใช้ได้จริง ; ไม่มีการรายงานของตัวแปรที่มีความสำคัญไม่แน่ชัด
การทดสอบทางพันธุกรรมก่อนการฝังตัว (PGT)
การทดสอบทางพันธุกรรมก่อนการฝังตัว สามารถระบุความผิดปกติทางพันธุกรรมในตัวอ่อนในระยะ บลาสตูซิสต์ (blastocyst) ซึ่งเป็นตัวอ่อนที่พัฒนาขึ้นในห้องปฏิบัติการหลังการปฏิสนธิเป็นเวลา 5 หรือ 6 วัน การทดสอบนี้ช่วยให้เราสามารถเลือกตัวอ่อนที่ดีที่สุด ซึ่งมีโอกาสสูงที่จะปราศจากภาวะทางพันธุกรรมและความผิดปกติของโครโมโซมสำหรับการย้ายตัวอ่อนเข้าสู่มดลูก
ประเภทของ PGT :
PGT-M : เดิมเรียกว่า PGD (การทดสอบทางพันธุกรรมก่อนการฝังตัวสำหรับโรคทางพันธุกรรมชนิดยีนเดียว) การทดสอบทางพันธุกรรมก่อนการฝังตัว (PGT) สำหรับโรคทางพันธุกรรมชนิดยีนเดียว เมื่อใช้โดยผู้ที่มีโอกาสถ่ายทอดโรคทางพันธุกรรมร้ายแรงให้กับลูก PGT ช่วยให้คู่รักสามารถมีลูกที่เป็นของพวกเขาทางพันธุกรรมโดยไม่ให้ลูกสืบทอดโรคทางพันธุกรรมที่เฉพาะเจาะจง ตัวอย่างของโรคที่อาจเกิดจากการเปลี่ยนแปลงในยีนเดียวซึ่งสามารถคัดกรองได้จากการทดสอบนี้ ได้แก่ โรคเนื้องอกไฟโบรมาโตซิสประเภท 1 (Neurofibromatosis Type 1), โรคมาร์ฟาน (Marfan Syndrome), โรคซีสต์ไฟโบรซิส (Cystic Fibrosis), โรคเทย์ แซ็กซ์ (Tay Sachs), ฮันติงตัน (Huntington's), โรคกล้ามเนื้ออ่อนแรง (Muscular Dystrophy), เบต้าธาลัสซีเมีย (Beta-thalassemia), Fragile X และ Spinal Muscular Atrophy
PGT-SR : การจัดเรียงโครงสร้างของโครโมโซม (เช่น ผู้พาหะของการเปลี่ยนตำแหน่งของโครโมโซม) การทดสอบนี้ช่วยผู้ที่มีโอกาสในการสูญเสียการตั้งครรภ์สูงหรือมีโอกาสตั้งครรภ์ต่ำเนื่องจากการเปลี่ยนตำแหน่งระหว่างโครโมโซม
PGT-A : การทดสอบอันยูพลอยดี (เดิมเรียกว่า PGS) เนื่องจากตัวอ่อนหลายตัวมีจำนวนโครโมโซมที่ผิดปกติ (ซึ่งเรียกว่า อันยูพลอยดี) PGT-A เป็นเครื่องมือที่มีประสิทธิภาพในการเลือกตัวอ่อนที่ดีสำหรับการย้ายตัวอ่อน การมีอันยูพลอยดีอาจนำไปสู่การแท้งบุตร, ความพิการแต่กำเนิด และภาวะแทรกซ้อนอื่น ๆ
ข้อควรรู้ :
ต้องได้รับอนุมัติจากคณะกรรมการจริยธรรมเพื่อดำเนินการ PGD ด้วยเหตุผลอื่นใด (เช่น "พี่น้องผู้ช่วยให้รอด") PGD ไม่สามารถใช้สำหรับการเลือกเพศในนิวซีแลนด์
TiMI
ถ่ายภาพตัวอ่อนทุก 10 นาทีเพื่อบันทึกเหตุการณ์สำคัญในการพัฒนาของตัวอ่อนที่มักจะพลาดไปเมื่อมีการตรวจสอบตัวอ่อนแค่วันละครั้ง
ประโยชน์ของ TiMI :
สามารถตรวจจับเหตุการณ์ที่ผิดปกติและเป็นอันตรายที่อาจหลุดพ้นจากการตรวจสอบภาพถ่ายรายวัน
ระบุตัวอ่อน 10-15% ที่มีศักยภาพต่ำมาก
การศึกษาหลายชิ้นแสดงให้เห็นว่า TiMI เพิ่มโอกาสในการตั้งครรภ์โดยใช้ตัวอ่อนตัวแรกที่ย้ายได้สูงถึง 10%
ตัวอ่อนจะไม่ถูกนำออกจากตู้อบ ดังนั้นพวกมันจะพัฒนาในสภาพแวดล้อมที่ไม่ถูกรบกวน
ใครที่สามารถได้รับประโยชน์จาก TiMI?
ผู้ที่คาดว่าจะมีตัวอ่อนคุณภาพดีหลายตัวให้เลือก
ผู้ที่เคยมีตัวอ่อนคุณภาพต่ำในอดีตและต้องการข้อมูลเพิ่มเติมเกี่ยวกับการพัฒนาของตัวอ่อน
การคัดเลือกเอ็มบริโอด้วย TiMI ไม่ได้เพิ่มโอกาสโดยรวมของทารกจากเอ็มบริโอที่มีอยู่ทั้งหมด แต่สามารถลดระยะเวลาในการตั้งครรภ์ได้ด้วยการเลือกเอ็มบริโอที่จะใช้ก่อนดีกว่า
TiMI และ PGT สามารถทำงานร่วมกันได้อย่างไร?
การทดสอบทางพันธุกรรมก่อนการฝังตัว (PGT) เป็นเครื่องมือในการเลือกตัวอ่อนที่แข็งแกร่งที่สุดที่เรามี เนื่องจากเรารู้ว่าตัวอ่อนที่ดูปกติหลายตัวอาจมีจำนวนโครโมโซมที่ผิดปกติ (อันยูพลอยดี)
ความท้าทายของ PGT คือการที่มันต้องการตัวอ่อนในระยะบลาสตูซิสต์ในวันที่ 5 หรือ 6 สำหรับการทดสอบ ซึ่งมักจะต้องมีอย่างน้อย 3 ตัวหรือมากกว่า TiMI จะช่วยเสริมการทำงานของ PGT เพราะมันสร้างสภาพแวดล้อมที่ดีที่สุดที่เรามีสำหรับการได้ตัวอ่อนในระยะบลาสตูซิสต์มากที่สุดเท่าที่จะเป็นไปได้ ขณะที่ข้อมูลเพิ่มเติมที่เราได้รับจากการดูตัวอ่อนด้วย TiMI จะเป็นประโยชน์เมื่อไม่ได้ใช้ PGS แต่จะไม่เพิ่มประสิทธิภาพในกระบวนการเลือกเมื่อใช้ PGS
ความท้าทายที่คนไข้ส่วนใหญ่ต้องเผชิญคือการไม่แน่ใจว่าจะมีตัวอ่อนกี่ตัวให้เลือก หากจำนวนตัวอ่อนน้อย TiMI เป็นวิธีที่ปลอดภัยในการเพิ่มโอกาสของคุณ หากมีตัวอ่อน 3 ตัวหรือมากกว่า PGS เพียงอย่างเดียวหรือการใช้ร่วมกับ TiMI อาจเป็นตัวเลือกที่ดีกว่า